肖景波,夏娇彬,陈居玲
(南阳东方应用化工研究所,河南 南阳,473000)
摘要:以硫酸分解镍渣。以氢氧化钠处理酸解残渣制得硅酸钠及高分散性白炭黑,提取酸解液中的铁制备高纯氧化铁,提取溶液中的镍收得镍精矿。将溶液进一步净化,采用氨法工艺制得氢氧化镁。实验找出了最佳工艺条件,确定了工艺流程,为炼镍废渣的综合利用开辟了一条新途径。
关键词:镍渣,综合利用,研究;
The investigation on the comprehensive utilization of waste residue of nickel metallurgy
Jingbo Xiao,Jiaobin Xia,Juling Chen
(Nanyang East Institute for Applied Chemistry,Nanyang 473000,Henan Province,China)
Abstract: The sulfuric acid solution was used to decompose the waste residue of nickel metallurgy. The sodium silicate and highly dispersed silica white can be obtained after the treating the residue originating from the acid process with sodium hydroxide; the high-purity iron oxide and the nickel concentrate can be obtained by extracting the iron from acid hydrolysis liquid and extracting the nickel from the solution, respectively. In addition, after the further purify, magnesium hydroxide products can be obtained by using the ammonia process. In the paper, we found the best process conditions and determined the technological process, which provide a new way to comprehensive use of waste residue of nickel metallurgy.
Key words: waste residue of nickel metallurgy, comprehensive utilization, investigation.
炼镍工业有大量的镍渣产生。据估算,每生产一吨金属镍废渣产出量在55吨左右。我国一些炼镍企业日产出废渣量少则几百吨,多则上千吨。由于没有合适的综合利用途径,形成了严重的环境负担[1]。炼镍废渣含有硅、镁、铁、钙、镍等有价元素,从已报道的情况看,可能的利用途径大致有以下几点:一是用于炼铁及制备微晶玻璃;二是水泥行业替代铁粉用作生产水泥的原料;三是用于回收硅钙合金。但由于受镍渣中化学组成的影响较大,如水泥行业时对其中的氧化镁含量有严格要求等,在工业上的应用受到一定程度的限制。为了寻找一条切实可行,易于实现工业化镍渣高效综合利用途径,我们进行了以湿法冶金工艺综合利用镍渣中各有价元素的研究 。
1 实验部分
1.1 实验原料
炼镍废渣,由江西航冠集团提供;
主要成份:MgO:31.51%; SiO2;52.28%;TFe:10%;CaO:0.67%; Ni:0.21%;
硫酸,AR;双氧水,AR;氨水,AR;氢氧化钠,AR;草酸,AR;铁粉,工业品;助剂FN,实验室配制;助剂LN,实验室配制;复合助剂JC,实验室配制。
1.2 实验仪器与设备
BS423S型电子天平;025-2F型电动搅拌机;HH-4型数显恒温水浴锅;SHB-ⅢA型循环水式多用真空泵;HG101型电热恒温鼓风干燥箱;XKMF-2000A型马弗炉。
1.3分析方法:
炼镍废渣成分分析按标准HG/T 3575-2006执行;试验过程铁、镁、镍、硅、钙等元素成分分析按标准HG/T 3575-2006执行;水玻璃分析按标准GB/T 4209-2008 执行;白炭黑分析按标准HG/T 3061-2009执行;高纯氧化铁按标准HG/T2574-2009执行;镍精矿分析按标准YS/T 340-2005执行。
1.4 实验方法
称取一定量的镍渣粉末,置烧杯中,加水并搅拌均匀。然后加入助剂FN和硫酸,在加温和搅拌的条件下进行酸解反应。反应结束后进行抽滤,收得酸浸出液和酸浸残渣。将酸浸残渣进行洗涤,再与水混合并加入计算量的氢氧化钠,经反应、过滤制得水玻璃[2]。采用浓酸法工艺在特殊工艺条件下对水玻璃进行处理,制得高分散性白炭黑产品[3]。向酸浸出液中加入氧化剂,使其中的二价铁转化为三价铁。然后在有底液存在的条件下,将氧化后的酸浸出液与PH控制剂加入底液中,经反应生成铁沉淀物。将铁沉淀物分离、精制、脱水然后与硫酸作用生成硫酸铁,经过滤制得硫酸铁溶液。将硫酸铁溶液精制[4],并向精制的铁溶液中加入氧化剂,再采用氧化沉淀法工艺制得高纯铁沉淀物。将高纯铁沉淀物分离、漂洗、脱水、煅烧制得高纯氧化铁产品[5]。
向沉铁后溶液加入硫化物,使其中的镍转化为硫化镍沉淀。再经过滤、洗涤、干燥制得镍精矿。向提镍后溶液加入助剂LN,进一步去除溶液中的各种金属及非金属杂质[6]。向过滤后溶液中加入氨水,采用共沉淀的办法对溶液进行强化精制处理。经过滤制得精制硫酸镁溶液。将硫酸镁溶液与氨水反应,经陈化、分离、漂洗、脱水、干燥制得氢氧化镁产品[7]。
2 结果与讨论
镍渣是一种富含硅酸盐的固体工业废气弃物,以无机酸对其分解有一定难度。因此,本文将重点讨论酸解工艺条件。对各种有价元素的提取剂化合物的制备作一般论述。
2.1 镍渣的酸解
2.1.1 镍渣细度对分解率的影响
镍渣是一种复含硅酸盐的物质,以无机酸为分解剂对其进行酸解,从化学反应的角度看有一定的难度。但是,如果对镍渣进行粉碎并控制合适的细度将会增加其表面积,提高化学反应活性,有利于分解率的提高。为此,我们对镍渣进行了粉碎处理,并考察了镍渣细度对酸解过程分解率的影响。结果见图1:
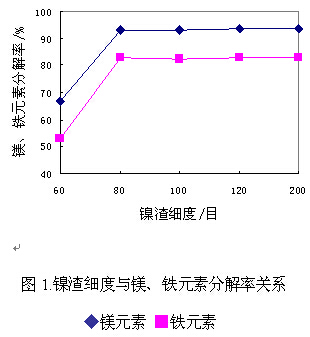
由图1可以看出,酸解过程镍渣分解率随镍渣细度的增加而升高,当细度达到80目时镁元素的分解率为92.8%,铁元素的分解率为82.6%。80目以后镁、铁元素的分解率升幅趋缓。因此,实验确定的镍渣细度为不小于80目,在此条件下镍渣分解率较高。
2.1.2酸解温度对分解率的影响
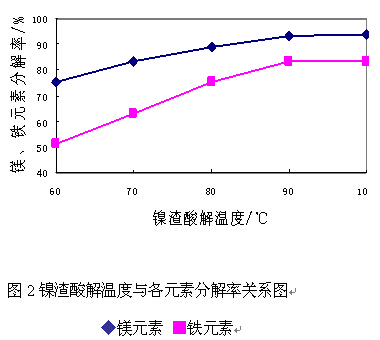
提高反应温度有利于加快反应速度,提高分解率,但过高的反应温度将会造成能耗增加。因此在控制镍渣粉碎细度为80目的条件下,实验考察了反应温度对镍渣中镁、铁元素分解率的影响。
由图2可以看出,镍渣分解率随温度升高而升高,当温度达到90℃时,继续提高酸解温度分解率升高不明显,因此,确定的优化工艺条件为:酸解过程反应温度为90℃-95℃。在此温度条件下,镍渣中镁、铁分解率分别在93.5%和83%以上。
2.1.3 PH值对分解率的影响
增加投酸量有利于分解率的提高,但酸性过强不仅会造成酸耗量的增加,而且还将给设备造成腐蚀。因此选择合适的加酸量对控制加工成本,延长设备使用寿命具有重要意义。实验以反应终点的PH值为考察对象,在固定镍渣细度为80目、酸解反应温度为90~95℃条件下,考察了不同PH对镍渣中镁、铁分解率的影响。结果见图3:
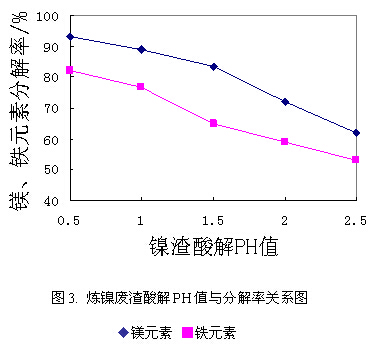
由图3可以看出,镍渣分解率随反应终点PH值的升高(酸性的减弱)而降低,随着PH值的下降(酸性的增强)而上升。当反应终点的PH值为1时,镍渣中镁、铁元素的分解率分别达到88.9%和76.9%,反应终点的PH值在0.5时镁、铁元素分解率分别可以达到93.2%和82.1%,但继续增加投酸量分解率增势不太明显。因此,实验确定为酸解反应终点的PH值为0.5。
2.1.4 反应时间对分解率的影响
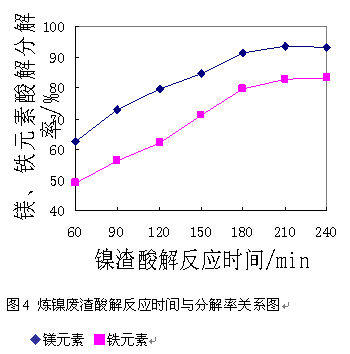
延长反应时间可以提高物料的反应程度,提高镍渣的分解率。但一味的延长反应时间,不仅会对生产能力造成影响,而且还将增加处理过程的运行成本。在固定镍渣细度为80目、酸解反应温度为90~95℃、酸解终点PH值为0.5的条件下,实验考察了反应时间对镍渣中镁、铁元素分解率的影响。结果见图4。
由图4可知,上述工艺条件下,镍渣分解率随反应时间增加而升高,当反应时间为210min时,镍渣中镁、铁分解率分别达到93.5%和82.5%,继续延长反应时间分解率增势趋缓。因此确定的反应时间为加完计算量的硫酸并达到温度条件后,保温反应210 min。
2.1.5 酸解助剂的选择及加入量对分解率的影响
考虑到镍渣为富含硅酸盐物质,以硫酸对其分解时有一定的难度。因此我们复配了FN、SN和LN三种助剂,以期增加酸解过程镍渣的化学活性。在前述优化工艺条件下,以投入镍渣矿粉质量的2%添加酸解助剂并进行酸解实验,不同品种的助剂对镍渣中镁、铁分解率的影响见5。

由图5可以看出,不同的反应助剂对镍渣分解率有不同程度的影响,对比三种助剂,助剂FN效果最好,因此选择助剂FN为镍渣酸解助剂。
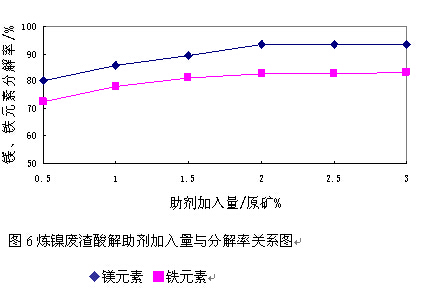
在确定反应助剂种类的条件下,又考察了不同助剂用量对镍渣分解率的影响。由图6可知,镍渣分解率随着助剂加入量的增加而升高,当加入助剂量为原矿质量的2%时,继续增加助剂加入量对分解率的影响不明显。因此确定助剂FN的加入量为镍渣质量的2%。
综上所述,对镍渣进行酸解反应的最佳工艺条件为:镍渣细度80-100目;酸解过程按投入镍渣质量2%加入酸解助剂,所使用的助剂为实验室配制的FN;反应终点PH值为0.5,反应温度为90-95℃,反应时间为加酸完成、温度达标后210min。在此条件下,镍渣中镁、铁元素分解率分别达到93.5%和83.1%。
2.2 有价元素的提取及化工产品的制备
2.2.1 高分散性白炭黑的制备
2.2.1.1 以酸解残渣制备水玻璃
酸解残渣的主要成份为二氧化硅,其干基二氧化硅含量高达97%,而且呈多孔结构,具有较大的比表面积和较高的化学活性。实验将漂洗后的酸解残渣与水混合,加入规定量的氢氧化钠,然后在加热条件下反应一定时间,再经过滤制得水玻璃。
实验确定的优化工艺条件为:配料固液比1:4;氢氧化钠用量根据所制备目标产品水玻璃的摩数进行随机调整;碱解反应温度70℃;碱解反应时间为添加完规定量的氢氧化钠,温度达标后30min。
在上述工艺条件下,以镍渣酸解残渣与氢氧化钠反应,SiO2分解率95.2%,可制得摩数为3-3.2,波美度为18-20 Be’的水玻璃产品。所制得的水玻璃用做制作高分散白炭黑的原料。
2.2.1.2高分散性白炭黑的制备
高分散性白炭黑是一种具有特殊晶体结构和良好分散性能的白炭黑产品,主要用于轮胎行业。实验以所制备的水玻璃为原料,首先以水玻璃、水和硫酸配制反应底液,然后在控制体系PH值稳定的前提下向装有反应底液的沉淀反应器中投加水玻璃和硫酸。加完计算量的水玻璃后继续加注硫酸,改变体系的PH值。当体系PH值达到特定值时停止加酸,此时反应体系内生成了白炭黑沉淀,再经陈化、分离、漂洗、脱水、干燥制得具有良好性能的白炭黑产品。经对各影响因素的考察,确定工艺条件为:
反应底液浓度:所制备的水玻璃与加入水的体积比为3:7;一步反应,即反应底液酸化反应终点的PH值为9;二步反应控制PH值为7;三步反应,即最后阶段反应终点的PH值为5;反应温度80℃;表面活性剂加入量为二氧化硅总量的2%;所使用的硫酸为浓硫酸;沉淀反应结束后陈化时间为60min。
在上述工艺条件下,SiO2收率达到90%,所制得的白炭黑主含量达到96%;吸油值 3-3.5 ml/g;比表面积 250-340 m2/g。具备高分散性白炭黑所应具有的特征。
2.2.2 高纯氧化铁的制备
2.2.2.1 从镍渣酸浸出液中沉淀铁的工艺选择及效果
镍渣酸解后,其中的铁以硫酸铁或硫酸亚铁的形态赋存于酸解液中。实验先后采用了氧化水解法、黄铁矾法以沉淀溶液中的铁,但以氧化水解法沉铁时,所生成的铁沉淀物为氢氧化铁,而氢氧化铁本身有较强的极性和化学活性。极易吸附溶液中的镁、镍离子。同时,在以氨或石灰乳做为PH值调节剂对氧化后的酸解液进行调节时,滴加过程由于受氨或石灰乳分散速度的影响,会造成反应体系局部碱性过强,导致氢氧化镁和氢氧化镍沉淀,而沉淀一旦生成又较难返溶,因此在沉铁过程会造成镁、镍资源的大量流失。实验证明,在以氧化水解法沉铁时体系中的镁、镍损失分别高达37%和25%,这对镁、镍资源的综合利用极为不利。同时,在以石灰乳做为PH值调节剂时又会生成一定量的硫酸钙。加之没有反应完全的氢氧化钙,会严重影响所获含铁沉淀物的纯度,给工艺铁资源的综合利用造成不利影响。黄铁矾法工艺中的黄钠铁矾法、黄氨铁矾法因受酸解液体系中化学组成的影响,在应用上有较大局限性。黄钾铁矾法虽然可以顺利实现对酸解液中铁元素的提取,但存在着成本过高的问题,同时沉铁过程镁、镍的带损也分别为17.5%和12.3%。鉴于这些情况,实验放弃了上述沉铁工艺,采用了氧化沉淀法沉铁工艺。
实验首先向酸浸出液中加入氧化剂,使其中的二价铁转化为三价铁;再配制特定浓度的PH值控制剂。向反应器中注入适量清水为底液(后续实验以沉铁后酸解液为底液)。在加热和搅拌条件下向底液中加经氧化的酸解液和PH值调节剂。工艺过程严格控制反应终点的PH值。反应完成,经过滤收得除铁后溶液和铁沉淀物。除铁后溶液用于镍精矿的制备和氢氧化镁的制备,铁沉淀物经净化处理、酸解、分离、净化、氧化、沉淀、分离、漂洗、煅烧后制得高纯氧化铁产品。
实验确定的最佳工艺条件为:
反应底液用量:加入氧化后镍渣酸解液体积的20%-30%;PH值控制剂浓度:PH值控制剂原液与水按1:10混配。酸解液与PH值控制剂的加入方式:并流滴加;反应温度75℃;反应终点PH值3.5;反应时间:加完计算量的酸解液后保温反应30min;酸解液与PH值控制剂的加入速度:将计算量的酸解液与PH值调节剂在30min内加完。
在上述工艺条件下,镍渣酸解液中铁沉淀率达到99.6%,沉铁过程镁带损率0.18%,镍带损率3.76%。既有效控制了镁、镍带损,又提高了含铁沉淀物的纯度,为高纯氧化铁的制备奠定了基础。
2.2.2.2高纯氧化铁的制备
实验所制得铁沉淀物含有一定量的铝、镁、镍等杂质。在制备高纯氧化铁时,首先对铁沉淀物进行漂洗,然后将沉淀物与水混合,打制成浆,再加入反应助剂,使其中的铝转化为可溶性铝盐,再经分离、洗涤制得精制铁沉淀物。将精制铁沉淀物进行酸解,制得硫酸铁溶液。然后去除铁溶液中的镁、镍等杂质,进一步制得纯净的硫酸铁溶液。加入氧化剂使溶液中少量的二价铁转化为三价铁。最后以纯水为底液,以并流的方式加入纯净硫酸铁溶液和PH调节剂,使溶液中的铁转化为新的纯度更高的铁沉淀物。再经分离、漂洗、脱水、干燥、煅烧制得高纯氧化铁。
实验确定的最佳工艺条件为:
含铁沉淀物漂洗终点:洗出液PH值为6.5;碱洗时氢氧化钠加入量:理论量;碱洗反应温度75℃;铁沉淀物酸解配料固液比:TFe:水=1:14;反应时间:配料完成后保温反应30min;反应终点PH值1.5。
溶液净化条件:
钙、镁的去除:反应温度80℃;反应时间30min,助剂加入量:理论量的3倍;
重金属的去除:反应温度75℃;反应时间30min;助剂加入量:理论量的10倍。
高纯铁沉淀物的制备:
反应底液:纯水,电导率小于5 S/m,底液用量:加入精制硫酸铁溶液的20%;
PH值控制剂:1+9氨水;
硫酸铁溶液与PH值控制剂加入速度:90min加注完毕;
沉铁过程反应温度:75℃;
沉铁反应终点PH值:3.5;
氧化铁煅烧温度:700℃;
氧化铁煅烧时间:180min;
在优化工艺条件下,经对铁沉淀物的处理制得的产物为α-Fe2O3型,氧化铁产品纯度在99.65%-99.82%之间。
2.2.3 镍精矿的制备
将沉铁后溶液送入沉镍反应器,在一定温度条件下加入硫化物溶液,使其中的镍生成硫化镍沉淀,经过滤、洗涤、干燥收得主要成分为硫化镍的镍精矿。实验确定的工艺条件为:
加入硫化物时溶液PH值:3.5-5.5;硫化物加入量:理论量的6倍;硫化物加入时料液温度:50℃;反应温度75℃;反应时间:75℃后30min。
在上述工艺条件下,溶液中镍沉淀率为98%,所制得的含镍沉淀物Ni含量28.97%,Fe含量0.28%。
2.2.4 氢氧化镁的制备
沉镍后溶液中还残留有一定量的金属或重金属杂质,不予去除将会影响氢氧化镁纯度。实验首先向除镍后溶液中加入氧化剂,然后在加热和搅拌条件下,加入某种碱性吸附剂。碱性吸附剂的加入使溶液的PH值发生变化,残余的金属杂质被进一步沉淀,同时所使用的碱性吸附剂具有较高的化学活性,对溶液中的金属、重金属杂质和有机、无机色素具有很强的吸附性能,因此依靠吸附剂的吸附作用使溶液得到进一步的净化。为制得高纯度的氢氧化镁产品,实验增加了强化精制工序,该工序以氨为沉淀剂对溶液进行共沉淀净化,经过滤制得纯净的硫酸镁溶液。然后,以氨为沉淀剂采用公知技术与精制硫酸镁溶液反应,制得了氢氧化镁产品。实验过程通过对各影响因素的考察,确定了最佳工艺条件:
溶液吸附净化剂用量:以溶液PH值稳定在7为准;吸附剂加入后反应温度:85℃;吸附反应时间:85℃以后30min;
共沉淀反应温度:加料温度:40℃;反应温度:50℃;共沉淀剂加入量:以被处理液出现浑浊为准;共沉淀反应时间:加完共沉淀反应剂后30min[8];
按照上述工艺条件,经处理除镍后溶液各种金属杂质分别被控制在5PPM以下。氢氧化镁制备过程镁转化率达到82%,氢氧化镁纯度达到99.6%,产品粒径被控制在2.5µm以下,可以满足阻燃、电子、医药等行业的需要。
2.2.5 确定的工艺流程
见附件。
3 结论
高分散白炭黑、高纯氢氧化镁、高纯氧化铁是应用前景广阔,附加值较高的化工产品。镍是十分珍贵的有色金属资源。炼镍废渣中富含硅、镁、铁、镍等有价元素,通过采用湿法冶金工艺制备上述化合物,实现对镍渣资源的综合利用,可以获得显著的经济效益和社会效益。
本研究通过实验找出了对镍渣进行综合利用的优化工艺条件,确定了工艺流程。在优化工艺条件下,镍渣中以镁、铁为代表的元素分解率分别达到93.5%和83.1%;酸解残渣中二氧化硅碱溶分解率95.2%,所制备的白炭黑主含量达到96%,吸油值 3-3.5ml/g,比表面积250-340m2/g,具备高分散性产物特点;溶液沉铁过程铁沉淀率达到99.6%,镁、镍带损得到有效控制,以此为基础所制备的高纯氧化铁为α-Fe2O3晶体,纯度最高达到99.82%,可应用于电子行业;溶液沉镍过程镍沉淀率98%,所收得的镍沉淀物Ni含量达到28.97%;所制备的氢氧化镁粒径被控制在2.5µm以下,纯度达到99.6%,收率达到82%。
参考文献
[1]王成彦,尹飞,陈永强等.国内外红土镍矿处理技术及进展[J].中国有色金属学报,2008(6):Vol.18 Special 1:s1-s8;
[2]陈虹,于少明,单承湘.由蛇纹石酸浸渣制取白炭黑工艺研究[J].化工矿物与加工,2010(4):20-24;
[3]赵杰,钱海燕.高分散性白炭黑的生产工艺和性能[J].化工新型材料2010(2):Vol.38,No.2:98-100;
[4]王汉栋等,钛白粉副产物硫酸亚铁的精致工艺.中华人民共和国专利局,CN1104999A;
[5]王国清,占寿祥,陈中等.高温下氧化铁红呈色的稳定性[J].化工时刊,2003,17(6):32-35;
[6]李秀芬.硫化钠从稀土矿淋出液中除重金属离子[J].矿产综合利用,June 2000,No.3:46-47;
[7]陈向锋, 黄西平,魏炳举等.一种生产环保型氢氧化镁的新工艺[J].盐业与化工,第37卷第1期:43-45;
[8] 胡庆福.《镁化合物生产与应用》[M].化学工业出版社,2004.318-319.



